Produktdesignprozesse für medizinische Geräte
Digitale Transformation
Die globale Digitalisierung verändert die Medizintechnikbranche. Innovationen werden zunehmend durch KI-gestützte und Cloud-basierte intelligente digitale Gesundheitslösungen, Software as a Medical Device (SaMD) oder das Internet der medizinischen Dinge (IoMT) vorangetrieben.
Um mit der durch Software ausgelösten Dynamik Schritt halten zu können, ist ein neuer Ansatz für die Entwicklungsprozesse von Medizinprodukten und die Überwachung nach dem Inverkehrbringen erforderlich, der die Vorteile der Digitalisierung nutzt und gleichzeitig alle Vorschriften einhält.
Ein digitales Ökosystem für Medizinprodukte
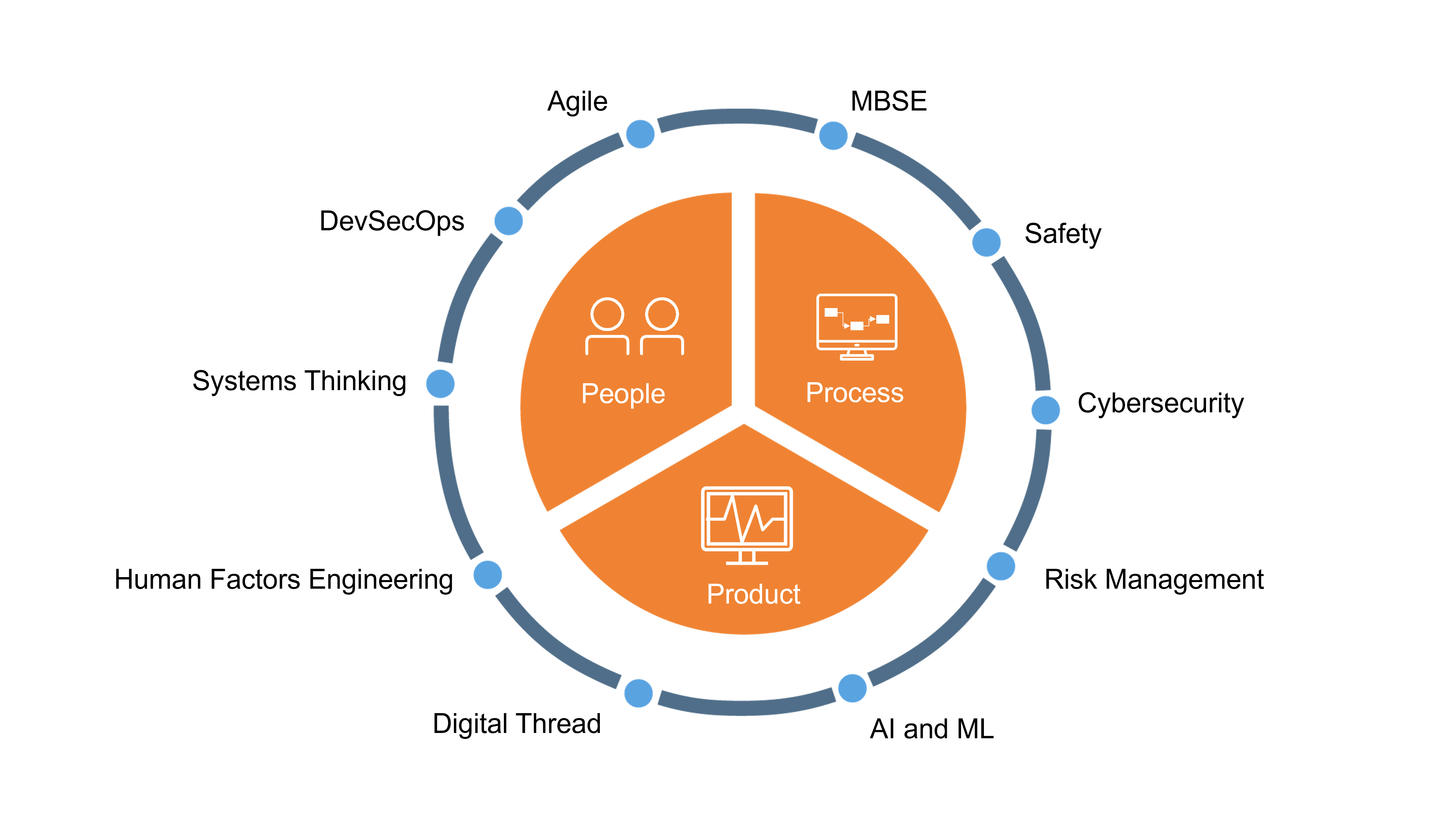
Um die Zeit bis zur Markteinführung zu verkürzen, haben führende Hersteller von Medizinprodukten erfolgreich "Software first"-Entwicklungskonzepte eingeführt, z. B.
- DevSecOps: Cybersicherheitsrisiken werden kontinuierlich als Teil der Entwicklungs- und Betriebsprozesse (DevOps) verwaltet und nicht als nachträgliche Maßnahme angewandt.
- Agile: Selbst im regulierten Umfeld der Medizinprodukte können agile Entwicklungsverfahren eingesetzt werden, um schneller auf sich ändernde Marktanforderungen und -bedingungen zu reagieren.
Die Abbildung zeigt typische Initiativen für das digitale Produktdesign. Alle haben starke Auswirkungen auf die im Qualitätsmanagementsystem (QMS) beschriebenen Prozesse. Die derzeitigen dokumentenzentrierten QMS sind jedoch zu statisch, um mit der neuen Dynamik Schritt zu halten, die durch Software entsteht. Der erfolgreiche Entwurf und Betrieb digitaler Medizinprodukte erfordert einen neuen Prozessansatz.
Unsere Lösung

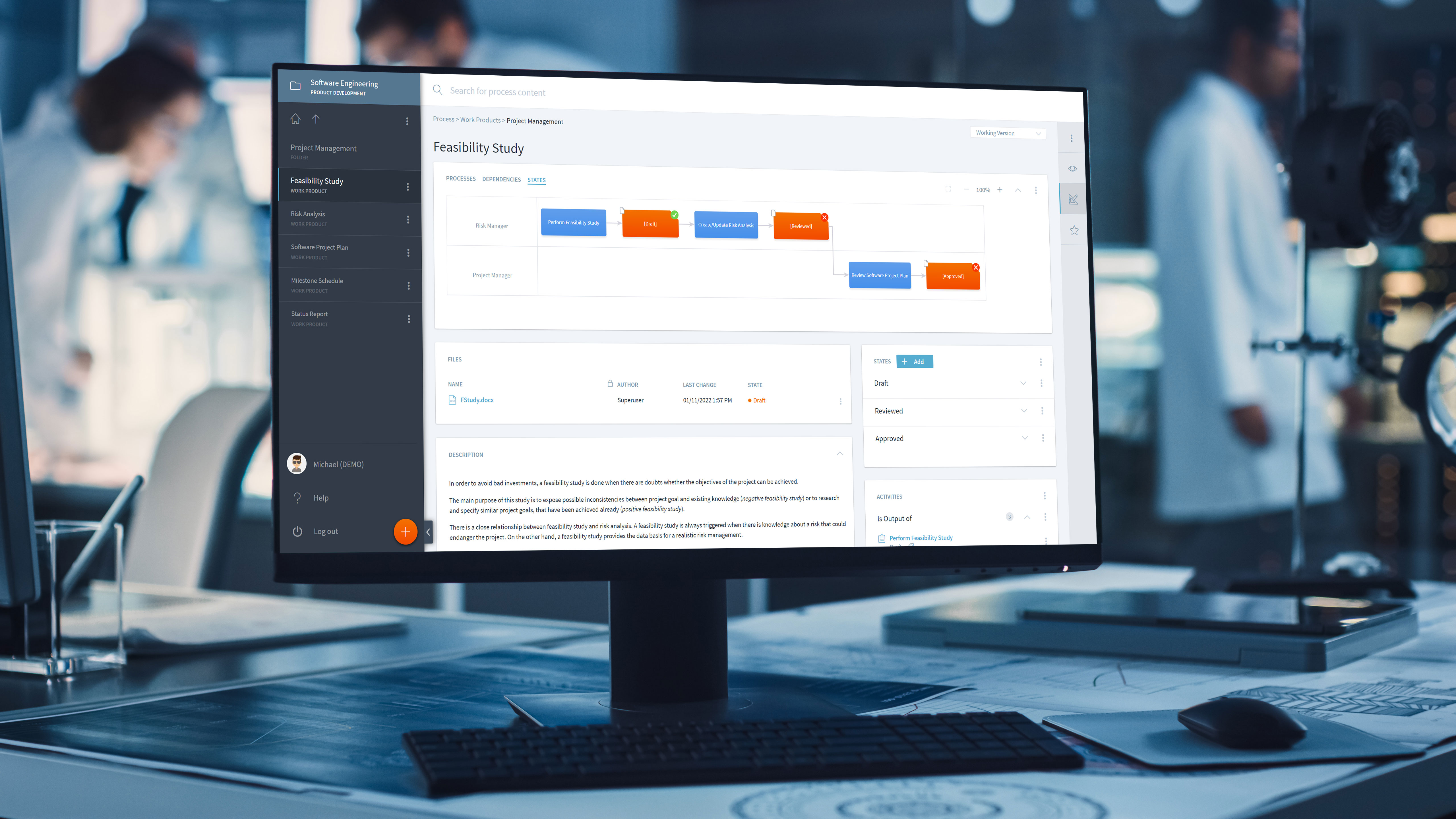
Stages ist die bewährte Plattform für die Umwandlung des QMS von einer statischen Dokumentenbibliothek in digitale, modellbasierte Prozesse.
Stages beschleunigt Produkteinführungen durch
- Definition adäquater Entwicklungsprozesse
- Übernahme neuer Verfahren und Techniken
- Aufbrechen von Silos zwischen Designteams und dem Rest der Organisation
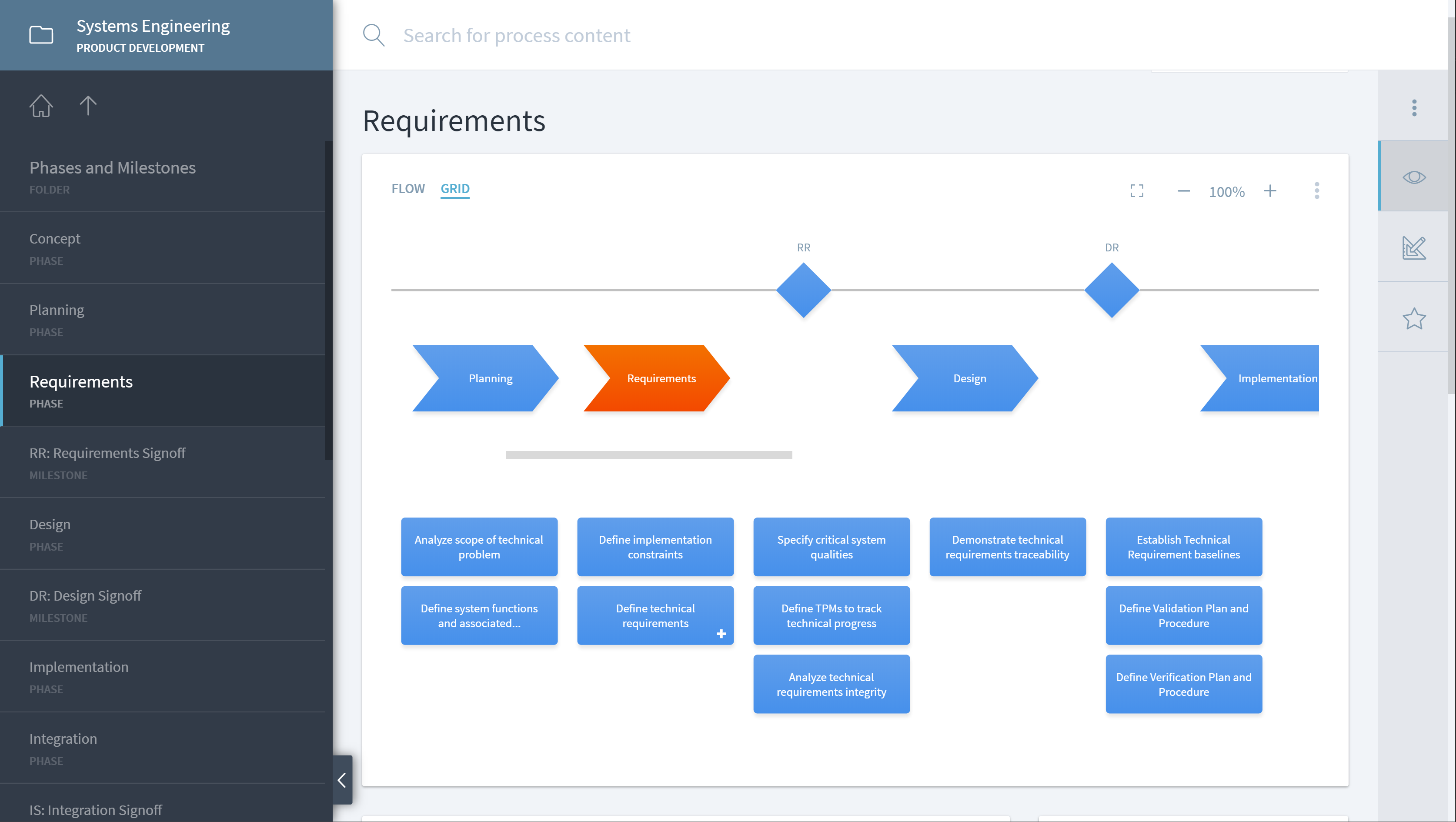
Regulatorische Unterstützung
Stages verfügt über einzigartige Funktionen zur Abbildung von Prozessen auf gesetzliche Anforderungen, wodurch sich der Aufwand für den Nachweis der Konformität um über 50% verringert.
Es ermöglicht die erfolgreiche Navigation durch die komplexe und sich entwickelnde regulatorische Landschaft für Medizinprodukte, einschließlich
- FDA 21 CFR 820
- EU MDR
- IEC 62304: Medical Device Software — Software Life Cycle Processes
- ISO 14971:2019, Medical devices — Application of risk management to medical devices
- ISO 13485:2016, Medical devices — Quality management systems — Requirements for regulatory purposes
- IEC 82304-1: Health software — Part 1: General requirements for product safety
- IEC 81001-5-1
- FDA Guidance: Cybersecurity in Medical Devices: Quality System Considerations and Content of Premarket Submissions
- ISO 27799: Health informatics — Information security management in health using ISO/IEC 27002
Interview mit Siemens Healthineers
Mit Stages bringen wir Menschen zusammen. Stages unterstützt uns bei der Harmonisierung unserer Prozesse und bei der Optimierung von Arbeitsabläufen unserer Engineers.Shamron Awwal, Senior Process Engineer, Siemens

Digitale Transformation der Entwicklungsprozesse für medizinische Geräte
Was Sie erfahren werden:
- Die Auswirkungen der digitalen Transformation auf Entwicklungsprozesse für softwareintensive medizinische Geräte
- Wie man die Dynamik von Software aus der Perspektive der Einhaltung von Vorschriften steuert
- Die Vorteile eines vollständig modellbasierten Ansatzes, der die statische Prozessdokumentation in MS Word und Excel ersetzt